NIM : A1C112013
KELAS: PENDIDIKAN KIMIA REGULER 2012
1. A. Jelaskan bagaimana asam
benzoat di sintesis dari suatu senyawa aromatik!
·
Oksidasi Toluene
dengan udara dalam fasa cair
Proses ini merupakan cara yang paling
awal digunakan, dimana toluene, katalis, dan udara (atau O2 yang
terkandung dalam udara)diumpankan secara kontinyu ke dalam autoclave sehingga
terbentuk asam benzoat pada suhu 150 – 250 0C dan tekanan 5-50
atm. Perbandingan udara dan toluene dikendalikan untuk mendapatkan konversi
10-50%. Panas reaksi dapat dihilangkan dengan refluks toluene dan
penggunaan jacket cooling. Autoclave secara kontinyu overflow ke stripper
kemudian toluene dipisahkan dan direcycle ke autoclave. Air yang terbentuk dari
kondensasi aliran gas harus segera dipisahkan sebelum toluene yang tidak
bereaksi dikembalikan ke reaktor. Pemisahan dapat dilakukan dengan
kristalisasi, distilasi, atau kombinasi keduanya. Yield yang diperoleh sekitar
80%. Asam benzoat yang terbentuk kemudian dibentuk menjadi flake atau
disublimasi untuk mendapatkan variasu ukuran untuk dijual.
·
Klorinasi Toluene
light
C6H5CH3 +
3 Cl2
===> C6H5CCl3 + 3
HCl
heat
ZnCl2
===>C6H5CCl3 + 2
H2O C6H5COOH + 3
HCl
(75
– 80%)
Toluene diklorinasi
pada 100-150 0C, hingga Specifik grafity mencapai 1,375-1,385
pada 20 0C Sedikit alkali dapat ditambahkan untuk netralisasi
residu hydrogen klorida. Benzotriklorid dapat didistilasi kemudian diumpankan
dalam bejana yang dilengkapi dengan agitator. Setelah dipanaskan sampai
100 0C, sekitar 0,7 % berat (berdasarkan umpan) Zinc
Chloridesebagai katalis. Kemudian air ditambahkan perlahan-lahan di bawah
permukaan cairan. Hidrogen klorid yang terlibat dalam reaksi diserap oleh air
membentuk hidroclorid acid. Temperatur akan naik secara
perlahan sampai 110-115 0C. Pada saat reaksi sempurna dimana
ditandai dengan tidak adanya hydrogen klorid, air ditambahkan, dan produk
reaksi dibiarkan sampai 0,5 jam dengan pengadukan. Temperatur diturunkan sampai
90-100 0C, air panas ditambahkan untuk melarutkan Zinc Klorid
dan hidroclorid acid sisa. Lapisan asam dipisahkan dan
dibiarkan mengeras, lapisan air didinginkan, hal ini mempercepat terlarutnya
asam benzoat, yang dipisahkan dengan filtrasi, dicuci dengan air dingin, dan
ditambahkan pada padatan asam benzoat. Komposisi padatan terdiri dari asam
benzoat crude dan jumlah yang bervariasi dari air, pumice,
dan impuritas yang lain. Ini dapat diubah menjadi Sodium benzoat kualitas
tinggi dengan melarutkan dalam Sodium hidroksid, penyaringan, dan pemurnian
larutan benzoat. Asam benzoat crude dapat dimurnikan dengan memberi USP asam
benzoat dengan beberapa cara seperti sublimasi atau kristalisasi. Yield 90%
dapat tercapai berdasarkan benzotriklorid yang diumpankan.
·
Dari benzaldehida
Disproporsionasi benzaldehida yang diinduksi oleh basa dalam reaksi Cannizzaro akan menghasilkan sejumlah asam benzoat dan benzil alkoholdalam jumlah
yang sama banyak. Benzil alkohol kemudian dapat dipisahkan dari asam benzoat
dengan distilasi.
B. jelaskan bagaimana mensintesis asam salisilat dari asam benzoat tersebut di
atas
Menurut saya,pembuatan
( sintesis ) asam salisilat dari asam benzoat dilakukan dengan cara
menghidroksilasi asam benzoat.Hidroksilasi merupakan reaksi yang menambahkan
gugus hidroksil pada senyawa senyawa organik.Pada reaksi ini bagian substrat
yang berupa atom karbon jenuh ( C-H) akan digantikan oleh gugus (O-H) menjadi
(C-OH).Proses ini bersifat oksidatif.
Dapat membentuk asam
salisilat melalui reaksi asam benzoat dan chloro acetic acid dengan katalis
NaOH . reaksi :
OOCCH2OC6H4COOH +
ClCH2COOH OH- C7H6O3
Asam benzoate chloro acetic acid ---→ asam salisilat
12. Jelaskan mengapa fenol dapat di gunakan
sebagai antiseptik!, mengapa alkohol tidak memiliki kemapuan demikian?
Fenol mempunyai gugus
yang seperti alkohol akan tetapi gugus fungsinya melekat langsung pada cincin
aromatik. Tata namanya biasa dipergunakan nama yang lazim dengan akhiran –Ol.
Fenol mempunyai
sifat-sifat yaitu :
·
Mempunyai sifat asam. Atom H dapat
diganti tak hanya dengan logam (seperti alkohol) tetapi juga dengan basa,
terjadi fenolat. Sifat asam dari fenol-fenol lemah dan fenolat ini dapat
diuraikan dengan asam karbonat.
·
Mudah dioksidasi, juga oleh O2 udara dan
memberikan zat-zat warna,mereduksi larutan fehling dan Ag- beramoniak.
·
Memberi reaksi-reaksi berwarna dengan
FeCl3.
·
Mempunyai sifat antiseptik, beracun,
mengikis, Ka = 1 x 10-10
Fenol
dapat digunakan sebagai antiseptik karena dapat membunuh atau menghambat pertumbuhan mikroorganisme pada jaringan yang hidup seperti pada
permukaan kulit dan membran mukosa.
Namun, antiseptik
yang kuat dan dapat mengiritasi jaringan kemungkinan dapat dialihfungsikan
menjadi disinfektan contohnya adalah fenol
yang dapat digunakan baik sebagai antiseptik maupun disinfektan
. Fenol adalah zat
pembaku daya antiseptik obat lain sehingga daya antiseptik dinyatakan dalam
koefesien fenol. Mekanisme kerja fenol sebagai desinfektan yaitu dalam kadar
0,01%-1% fenol bersifat bakteriostatik. Larutan 1,6% bersifat bakterisid, yang
dapat mengadakan koagulasi protein. Ikatan protein dengan fenol mudah lepas,
sehingga fenol dapat berpenetrasi ke dalam kulit utuh. Larutan 1,3% bersifat
fungisid, berguna untuk sterilisasi ekskreta dan alat kedokteran.
Senyawa turunan fenol berinteraksi dengan sel bakteri melalui proses adsorpsi yang melibatkan ikatan hidrogen. Pada kadar rendah terbentuk kompleks protein fenol dengan ikatan yang lemah dan segera mengalami peruraian, diikuti penetrasi fenol ke dalam sel dan menyebabkan presipitasi serta denaturasi protein. Pada kadar tinggi fenol menyebabkan koagulasi protein sel dan membran sitoplasma mengalami lisis.
Senyawa turunan fenol berinteraksi dengan sel bakteri melalui proses adsorpsi yang melibatkan ikatan hidrogen. Pada kadar rendah terbentuk kompleks protein fenol dengan ikatan yang lemah dan segera mengalami peruraian, diikuti penetrasi fenol ke dalam sel dan menyebabkan presipitasi serta denaturasi protein. Pada kadar tinggi fenol menyebabkan koagulasi protein sel dan membran sitoplasma mengalami lisis.
Alkohol dapat pula digunakan sebagai
antiseptik. Alkohol membunuh kuman dengan cara menggumpalkan protein dalam
selnya. Kuman dari jenis bakteri, jamur, protozoa dan virus dapat terbunuh
oleh alkohol. Alkohol (yang biasanya dicampur yodium) sangat umum digunakan
oleh dokter untuk mensterilkan kulit sebelum dan sesudah pemberian suntikan
dan tindakan medis lain. Alkohol kurang cocok untuk diterapkan pada luka
terbuka karena menimbulkan rasa terbakar.
Jenis alkohol yang digunakan sebagai
antiseptik adalah etanol (60-90%), propanol
(60-70%) dan isopropanol (70-80%) atau campuran dari
ketiganya. Metil alkohol (metanol) tidak boleh digunakan sebagai
antiseptik karena dalam kadar rendah pun dapat menyebabkan gangguan saraf
dan masalah penglihatan. Metanol banyak digunakan untuk keperluan industri.
3. A. Perekasi
Fehling adalah oksidator lemah yang merupakan pereaksi khusus untuk mengenali aldehida.
Pereaksi
Fehling terdiri dari dua bagian, yaitu Fehling A dan Fehling B. Fehling A
adalah larutan CuSO4, sedangkan Fehling B merupakan campuran larutan NaOH dan
kalium natrium tartrat. Pereksi Fehling dibuat dengan mencampurkan kedua
larutan tersebut, sehingga diperoleh suatu larutan yang berwarna biru tua.
Dalam pereaksi Fehling, ion Cu2+ terdapat sebagai ion kompleks. Pereaksi
Fehling dapat dianggap sebagai larutan CuO.
Bila
eter dididihkan dalam air yang mengandung asam (umumnya H2SO4)
terjadilah hidrolisis yang memberikan hasil alkohol. Contoh:
C2H5-O-C2H5 + H2O
→ 2 C2H5OH ( etanol )
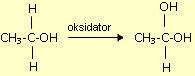
Reaksi oksidasi alkohol primer akan membentuk aldehida, sedangkan oksidasi
alkohol sekunder menghasilkan keton.
Reaksi oksidasi etanol dapat dianggap berlangsung sebagai berikut:
senyawa dengan 2 gugus OH terikat pada suatu atom karbon bersifat tidak
stabil, dan terurai dengan melepaskan1 molekul air. Jadi, senyawa yang
terbentuk pada reaksi diatas segera terurai sebagai berikut:
B. hasil dari tersebut di atas bila dioksidasi lebih lanjut akan
menghasilkan senyawa X , tentukan cara mengidentifikasinya!
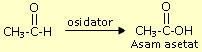
Etanal yang dihasilkan dapat teroksidasi lebih lanjut membentuk asam karboksilat. Hal ini terjadi
karena oksidasi aldehida lebih mudah daripada oksidasi alkohol.
IDENTIFIKASI ASAM KARBOKSILAT (Asam Asetat)
·
Sodium Bicarbonat Test
Larutkan sedikit campuran yang tersedia kadalam larutan sodium bicarbonat
5%. Amati larutan tersebut, jika campuran tersebut bersifat asam, maka akan
terbantuk gelembung – gelembung CO2.
RCOOH + NaHCO3 RCOO-Na+ + H2CO3
H2CO3
CO2 + H2O
Gas / gelembung
Dapat dilakukan dengan memasukkan 1 ml larutan sampel asam asetat (yang
ingin diuji) ke dalam tabung reaksi dan ditambahkan dengan larutan feri
klorida. Hasil percobaan yaitu warna larutan berubah menjadi orange. Perubahan warna yang dihasilkan pada
percobaan ini menunjukkan adanya reaksi antara larutan asam asetat dengan
larutan feri klorida.
4. Mengapa suatu eter bisa lebih reaktif
dari pada alkohol, padahal secara umum alkohol lebih reaktif dari pada eter
apabila di reaksikan dengan logam? (seperti Na) jelaskan dasar-dasar ilmiah
yang memungkinkan suatu eter lebih reaktif dari pada alkohol!
Secara umum eter tidak sereaktif alkohol kecuali dalam reaksi
pembakaran.Eter memiliki titik didih yang lebih rendah dari pada alkohol.
Reaksi pembakaran eter
CH3-O-CH3 + 3O2 → 2CO2 + 3H2O
seperti halnya alkohol dan senyawa2 karbon yang lain reaksi oksidasi akan
menghasilkan hasil akhir CO2 dan H2O
• Reaksi pembakaran alkohol
Reaksi oksidasi alkohol juga menghasilkan hasil akhir CO2 dan H2O
C2H5OH(l) + 3O2 → 2 CO2(g) + 3H2O(g) + kalor
5. Bila fenol dikatakan lebih asam dari
pada alkohol temukan contoh suatu alkohol jauh lebih asam dari pada fenol!
Jelaskan mengapa demikian!
Fenol merupakan asam yang lebih kuat dibandingkan alkohol atau air.
Kekuatan asam fenol kira-kira ditengah antara etanol dan asam asetat. Kekuatan asam sangat dipengaruhi oleh substituen yang terikat pada gugus
alkil.Keasaman pada alkohol dapat ditingkatkan apabila alkohol berada dekat
dengan gugus penarik elektron seperti fenil atau halogen.Apabila gugus penarik
elektron berada dekat dengan alkohol,maka senyawa alkohol tersebut akan berubah
menjadi senyawa haloalkana yang memiliki tingkat keasaman lebih tinggi dari
pada fenol.Klorida merupakan penarik
elektron yang dapat direaksikan dengan alkohol untuk menaikan tingkat keasaman.
Alkohol tersier bereaksi cukup cepat dengan asam hidroklorat pekat, tapi
untuk alkohol primer atau sekunder, laju reaksi cukup lambat sehingga
reaksi-reaksinya tidak terlalu penting.
Alkohol tersier bereaksi jika dikocok dengan asam hidroklorat pekat pada
suhu kamar. Halogenalkana tersier (haloalkana atau alkil halida) terbentuk.
6. Etanol berfungsi digunakan sebagai bahan
bakar, bagaimana halnya dengan turuna alkohol yang lain yang memungkinkan di
gunakan sebagai bahan bakar,?
apa syarat-syaratnya? Dan berikan contoh!
Empat alkohol alifatik pertama, yaitu (metanol, etanol, propanol, dan
butanol) adalah jenis alkohol yang sering digunakan sebagai bahan bakar karena
alkohol-alkohol ini dapat disintesis secara kimia maupun biologi, dan
karakteristik yang dimiliki membuat alkohol ini dapat dipakai pada mesin-mesin
modern saat ini. Salah satu keuntungan yang dimiliki oleh keempat jenis alkohol
ini adalah angka oktan yang tinggi. Angka oktan yang tinggi dapat membuat
efisiensi bahan bakar meningkat sehingga dapat menutupi kepadatan energinya
yang rendah (jika dibandingkan dengan bensin/diesel).
Syarat-Syarat Bahan Bakar
·
Volatilitas bahan bakar
Volatilitas bahan bakar didefinisikan sebagai kecenderungan cairan bahan
bakar untuk menguap. Pada motor bensin, campuran bahan bakar dan udara yang
masuk dalam silinder sebelum dan sesudah selama proses pembakaran diusahakan
sudah dalam keadaan campuran uap bahan bakar dan udara, sehingga memudahkan
proses pembakaran. Oleh karena itu kemampuan menguapkan bahan bakar untuk motor
bensin sangat penting.
·
Angka Oktan
Angka Oktan adalah suatu bilangan yang menunjukkan sifat anti ketukan
(denotasi). Dengan kata lain, makin tinggi angka oktan maka semakin berkurang
kemungkinan untuk terjadinya denotasi (knocking). Dengan berkurangnya
intensitas untuk berdenotasi, maka campuran bahan bakar dan udara yang
dikompresikan oleh torak menjadi lebih baik sehingga tenaga motor akan lebih
besar dan pemakaian bahan bakar menjadi lebih hemat.
·
Kesetabilan kimia dan kebersihan bahan bakar
Kestabilan kimia bahan bakar sangat penting, karena berkaitan dengan
kebersihan bahan bakar yang selanjutnya berpengaruh terhadap sistem pembakaran
dan sistem saluran. Pada temperatur tinggi, bahan bakar sering terjadi polimer
yang berupa endapan-endapan gum (getah) ini berpengaruh kurang baik terhadap
sitem saluran misalnya pada katup-katup dan saluran bahan bakar.
Bahan bakar yang mengalami perubahan kimia, menyebabkan gangguan pada
proses pembakaran. Pada bahan bakar juga sering terdapat saluran/senyawa yang
menyebabkan korosi, senyawa ini antara lain : senyawa belerang, nitrogen,
oksigen, dan lain-lain , kandungan tersebut pada gas solin harus diperkecil
untuk mengurangi korosi, korosi dari senyawa tersebut dapat terjadi pada
dinding silinder, katup, busi, dan lainya, hal inilah yang menyebabkan awal
kerusakan pada mesin.
Salah satu contoh turunan alkohol sebagai bahan bakar adalah Metanol dan
etanol, keduanya bisa didapatkan baik dari minyak bumi, biomassa, atau mungkin
yang paling mudah, dari karbon dioksida dan air. Etanol secara umum diproduksi
melalui fermentasi gula, dan metanol biasanya diproduksi dari fermentasi gas.
Jika digunakan sebagai bahan bakar, etanol memiliki kelebihan dan kekurangan
masing-masing bila dibandingkan dengan bahan bakar biasa seperti bensin dan
diesel. Kedua bahan bakar alkohol ini membutuhkan rasio kompresi yang tinggi
agar mesin bisa menyala. Kedua alkohol ini memiliki angka oktan yang tinggi,
dengan angka oktan 109. Selain itu, kedua bahan bakar alkohol ini memiliki
angka cetan yang rendah, sehingga cairan pembantu penyulut (ignition improver)
seperti contohnya glikol harus ditambahkan ke dalam campuran bahan bakar ini
sampai kandungannya mencapai 5%, Ketika dipakai, bahan bakar alkohol ini dapat
berpotensi mengurangi NOx, CO, HC dan partikulat lainnya. Sebua tes yang
dilakukan pada Chevrolet Luminas berbahan bakar E85 menunjukkan bahwa NMHC
berkurang 20-22%, NOx berkurang 25-32% dan CO berkurang 12-24% bila
dibandingkan dengan pemakaian bensin. Emisi racun dari benzena dan 1,3
butadiena juga menurun, tapi emisi aldehida (misalnya asetaldehida).
Metanol dan etanol juga mengandung beberapa zat yang dapat dan tidak dapat
larut. Misalnya adalah ion halida, yang merupakan zat yang dapat larut,
mempunyai andil yang besar dalam membuat bahan bakar alkohol menjadi korosif.
Untuk menghindari korosi maka sistem bahan bakarnya harus diganti dengan
material yang cocok, kawat listriknya harus diisolasi dan sensor bahan bakar
harus yang bertipe pulse and hold