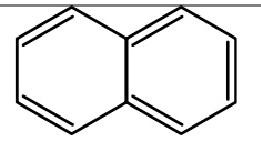
Naftalena
adalah hidrokarbon kristalin aromatik berbentuk padatan berwarna putih
dengan rumus molekul C10H8 dan berbentuk dua cincin benzena yang
bersatu. Senyawa ini bersifat volatil, mudah menguap walau dalam bentuk
padatan. Uap yang dihasilkan bersifat mudah terbakar. Naftalena paling
banyak dihasilkan dari destilasi tar batu bara, dan sedikit dari sisa
fraksionasi minyak bumi.
Senyawa
ini bersifat volatil, mudah menguapwalau dalam bentuk padatan. Uap yang
dihasilkan bersifat mudahterbakar. Naftalena paling banyak dihasilkan
dari destilasi tar batu bara, dan sedikit darisisa fraksionasi minyak
bumi. Naftalena merupakan suatu bahan keras yang putih dengan bau
tersendiri, dan ditemui secara alami dalam bahan bakar fosil seperti
batu bara danminyak.
Naftalena adalah salah satu komponen yang termasuk benzena aromatik
hidrokarbon, tetapitidak termasuk polisiklik. Naftalena memiliki
kemiripan sifat yang memungkinkannyamenjadi aditif bensin untuk
meningkatkan angka oktan. Sifat-sifat tersebut antara lain: sifat
pembakaran yang baik, mudah menguap sehingga tidak meninggalkan getah
padat pada bagian-bagian mesin. Penggunaan Naftalena sebagai aditif
memang belum terkenal karenamasih dalam tahap penelitian. Sampai saat
ini memang belum diketahui akibat buruk penggunaan naftalena terhadap
lingkungan dan kesehatan, namun ia relatif aman untuk digunakan.Satu
molekul napthalena merupakan perpaduan dari sepasang cincin benzena.
Naftalenamerupakan salah satu jenishidrokarbon polisiklik aromatik .
Ada dua set atom hidrogensetara: posisi alpha (posisi 1, 4, 5, dan 8),
dan posisi beta (posisi 2, 3, 6, dan 7) padagambar di bawah. 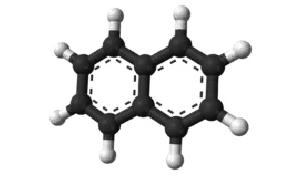
Sesuai dengan ikatan valensinya, napthalena mempunyai tiga struktur resonansi yaitu :Seperti benzena, naftalena dapat mengalamisubstitusi aromatik elektrofilik .
Pada sebagian besar reaksi substitusi aromatik elektrofilik, naftalena
bereaksi dalam kondisi lebih ringandaripada benzena. Sebagai contoh,
benzena ataupun napthalena bila beraksi dengan klorindengan menggunakan
besi klorida atau aluminium klorida sebagai katalis, naftalena danklorin
dapat bereaksi untuk membentuk 1-chloronaphthalena bahkan tanpa
menggunakankatalis. Benzena dan naphthalene juga dapat dialkilasi
menggunakanreaksi Friedel-Crafts,naftalena juga dapat dialkilasi dengan
mereaksikannya dengan alkena atau alkohol, menggunakansulfatatauasam fosfatsebagai katalis.
Sifat Fisik
| Massa molar Kepadatan Titik lebur Titik didih Kelarutan dalam air | 128,17052 g 1,14 g / cm ³ 80,26 ° C, 353 K, 176 ° F 218 ° C, 491 K, 424 ° F 30 mg / L |
/ molPenampilan Putih solid kristal / serpih, bau kuat dari tar batubaraSekitar Data di atas berlaku padatemperatur dan tekanan standar
Top of Form
SUBSTITUSI AROMATIK ELEKTROFILIK
Reaksi
substitusi elektrofilik terjadi pada senyawa aromatis, tidak hanya pada
senyawa monosiklik seperti benzena, tetapi juga terjadi pada senyawa
aromatis polisiklik seperti naftalena dan senyawa heteroaromatis seperti
furan, pirol, dan tiofena. Reaksi substitusi aromatik elektrofilik pada
benzena sudah sering kali dibahas. Sekarang, bagaimana reaksi ini
terjadi pada senyawa aromatis polisiklik seperti naftalena dan senyawa
heteroaromatis seperti furan, pirol, dan tiofena?.
Sistem
cincin senyawa aromatik polisiklik mempunyai nama individual. Berbeda
dengan penomoran benzena, yang dimulai pada posisi suatu substituen.
Penomoran suatu cincin polisiklik ditetapkan berdasarkan perjanjian dan
tidak berubah bagaimanapun posisi substituennya.
Sistem
cincin aromatik polisiklik lebih reaktif terhadap serangan elektrofilik
daripada benzena. Naftalena mengalami reaksi substitusi aromatik
elektrofilik terutama pada posisi-1. Mekanisme untuk substitusi
naftalena serupa dengan mekanisme substitusi benzena. Akan kita periksa
reaksi brominasi bertahap untuk mengetahui mengapa substitusi pada
posisi–1 lebih disukai dan mengapa reaksi ini lebih mudah terjadi
daripada brominasi benzena.
Kegunaan
Naftalena
digunakan sebagai reaksi intermediet dari berbagai reaksi kimia
industri, seperti reaksi sulfonasi, polimerisasi, dan neutralisasi.
Selain itu, naftalena juga berfungsi sebagai fumigan (kamper, dsb),
surfaktan, dsb
Efek yang mungkin dari naftalena terhadap kesehatan
Eksposur
terhadap jumlah besar naftalena dapat mengakibatkan kerusakan pada sel
darah,dan menyebabkan penyakit yang dikenal sebagai haemolytic anaemia.
Penyakit ini telahdiperhatikan pada orang tertentu, terutama anak-anak,
setelah termakan kapur barus yangmengandung naftalena. Antara gejala
yang mungkin terjadi setelah eksposur terhadap jumlah besar naftalena
adalah lelah, hilang nafsu makan, mual, muntah dan diare. Kulitmungkin
menjadi pucat atau kuning. Bayi yang baru lahir terutama menghadapi
risiko seldarahnya rusak jika terpajan pada naftalena. Kerusakan
terhadap sel darahnya melepaskansuatu produk (bilirubin) yang
menyebabkan bayi tersebut menjadi kuning dan dalam kasus parah, mungkin
mengakibatkan kerusakan otak. Ada orang yang lahir dengan penyakitlahir
genetis (G6PD deficiency) yang menjadikannya lebih cenderung menderita
akibatdari naftalena, maka gejala dapat diperhatikan setelah eksposur
terhadap jumlah naftalenayang kecil pun.
Permasalahan :
Dari artikel diatas disebutkan bahwa naftalena memiliki sistem cincin aromatik polisiklik yang ternyata lebih reaktif terhadap serangan elektrofilik
daripada benzena.Mengapa bisa demikian?
Baiklah saya akan mencoba menjawab tentang permasalahan di atas.Reaksi substitusi elektrofilik terjadi pada senyawa aromatis, tidak hanya pada senyawa monosiklik seperti benzena, tetapi juga terjadi pada senyawa aromatis polisiklik seperti naftalena.Struktur-struktur resonansi dari zat untuk substitusi pada posisi–1 menunjukkan dua penyumbang yang mana cincin benzena utuh. Karena stabilisasi-resonansi aromatik, kedua struktur ini berenergi lebih rendah daripada struktur-struktur resonansi lainnya dan merupakan penyumbang utama pada struktur real zat. Inilah sebabnya mengapa naftalena lebih mudah bereaksi substitusi elektrofilik daripada benzena.Sehingga ia lebih reaktif dari pada serangan elektrofilik benzena.
BalasHapusSenyawa aromatik polisiklik lebih reaktif terhadap serangan oksidasi, reduksi, dan substitusi dibandingkan senyawa benzena. Kereaktifan ini disebabkan kemampuan bereaksi dari suatu cincin, sementara cincin lainnya masih dipertahankan.
BalasHapus1) Reaksi Oksidasi
Asam ftalat anhidrida dibuat dari oksidasi naftalena dengan katalis vanadium oksida. Persamaan reaksinya:
Asam ftalat anhidrida
Asam ftalat anhidrida 1
Ftalosianina merupakan zat warna biru (monastral) pada tektil, disintesis dari bahan dasar asam ftalat Anhidrida Antrasena dan fenantrena dapat juga dioksidasi menjadi suatu kuinon.
2) Reaksi Reduksi
Berbeda dari benzena, senyawa polisiklik dapat dihidrogenasi (direduksi) parsial pada tekanan dan suhu kamar.
Reaksi Reduksi
Perhatikan bahwa sistem cincin yang tereduksi parsial masih mengandung cincin benzena. Sebagian besar sifat aromatik dari sistem cincin masih ada dan dipertahankan. Untuk menghidrogenasi semua cincin aromatik dalam naftalena dapat dilakukan pada suhu dan tekanan tinggi.
cincin aromatik dalam naftalena
3) Reaksi Substitusi
Sistem cincin aromatik polisiklik lebih reaktif terhadap serangan substitusi daripada benzena. Naftalena mengalami reaksi substitusi terutama pada posisi atom karbon nomor-1. Beberapa contoh reaksi substitusi aromatik polisiklik di antaranya reaksi brominasi dan reaksi sulfonasi.
a) Reaksi brominasi
Berdasarkan hasil percobaan diketahui bahwa naftalena dapat dibrominasi pada suhu kamar menggunakan katalis FeBr3. Reaksi yang terjadi menggunakan mekanisme reaksi yang ditunjukkan sebagai berikut.
Br2 + FeBr3 →FeBr4– + Br+
FeBr4– ⇆ FeBr3 + Br–
Reaksi brominasi
b) Reaksi sulfonasi
Reaksi sulfonasi pada naftalena dilakukan sama seperti pada sulfonasi benzena. Berdasarkan data hasil percobaan diketahui bahwa reaksi sulfonasi naftalena dipengaruhi oleh suhu.
Reaksi sulfonasi
Pada suhu di bawah 60°C, naftalena bereaksi dengan asam sulfat pekat membentuk asam 1–naftalenasulfonat, tetapi pada suhu tinggi di atas 160°C, menghasilkan campuran produk dari asam 2–naftalenasulfonat(85%) dan asam 1–naftalenasulfonat (15%).
Saya akan mencoba menjawab permasalahan yang anda tampilkan
BalasHapusSistem cincin aromatik polisiklik lebih reaktif terhadap serangan elektrofilik daripada benzena, hal ini dikarenakan Naftalena mengalami reaksi substitusi aromatik elektrofilik terutama pada posisi-1.
Struktur-struktur resonansi dari zat-antara untuk substitusi pada posisi–1 menunjukkan dua penyumbang yang mana cincin benzena utuh. Karena stabilisasi-resonansi aromatik, kedua struktur ini berenergi lebih rendah daripada struktur-struktur resonansi lainnya dan merupakan penyumbang utama pada struktur real zat-antara. Inilah sebabnya mengapa naftalena lebih mudah bereaksi substitusi elektrofilik dari pada benzena.